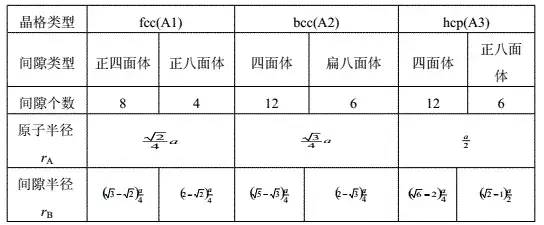
堆垛方式:
fcc:ABAB; bcc:ABCABC hcp:ABAB
三、多晶型性
元素的晶体结构随外界条件的变化而发生转变的性质。
四、影响原子半径的因素
(1) 温度与应力
(2) 结合键的影响
(3) 配位数的影响
(4) 核外电子分布的影响
合金的相结构
合金相:固溶体、中间相
固溶体
固溶体:溶质原子溶入基体中所形成的均匀结晶相。晶体结构保持基体金属的结构按溶质原子位置:置换固溶体、间隙固溶体
按固溶度分:无限和有限
按原子排列秩序:有序和无序
按溶剂类别分类:第一类固溶体和第二类固溶体
固溶体的性质:点阵畸变、固溶强化、物理化学性能、有序化影响
1 置换固溶体
(1)置换固溶体:溶质原子位于晶格点阵位置的固溶体。
(2)影响置换固溶体溶解度的因素a 原子尺寸因素b 晶体结构因素c 电负性因素d 电子浓度因素
2 间隙固溶体
3 固溶体的结构
(1)晶格畸变。
(2)偏聚与有序:完全无序、 偏聚、 部分有序、 完全有序。
4 固溶体的性能
(1)固溶强化:由于溶质原子的溶入而引起的强化效应。
(2)柯氏气团
(3)有序强化
金属间化合物
中间相的特征:具有不同于组元的晶体结构
原子间的结合方式: (金属键十其他键)混合,具有金属性
中间相的形成和晶体结构的影响因素:电负性、电子浓度、原子尺寸
间隙相与间隙化合物:根据非金属元素与金属元素的比值,当rx/rm<0.59,形成具有简单结构的化合物;否则,形成具有复杂结构的化合物,成为间隙化合物。
拓扑密堆相
由两种大小不同的原子所构成的类中间相,其中大小原子通过适当的配合构成空间利用率和配位数很高的复杂结构,具有拓扑学特点。
b) TCP相举例
I) Lavers相
典型分子式AB2,理论上原子半径比rA/rB=1.255
如MgCu(复杂立方)、 MgZn2(复杂六方)
且一定晶体结构对应着一定的电子浓度。对高度合金化不锈耐热钢、铁基高温合金和Ni基高温合金中均有发现,星针状析出于基体,对性能通常不利。但在Mg合金中它是重要的强化相。
II)б相(Sigma Phase)
存在于过渡族金属元素组成的合金中,其分子式为AB或AxBy复杂四方结构(c/a=0.52), 每个晶胞有30个原子在Ni基高温合金,NiCr不锈钢、耐热钢中均有发现,星片状,硬而脆,使塑性恶化
4.离子晶体结构
典型的离子晶体
这类晶体是以正离子、负离子为结合单元,即依靠正、负离子之间的库仑作用结合。例如NaCI晶体Na+、CI- 为单元结合成的。
陶瓷材料的晶体结构,大多属离子晶体,部分则为共价晶体。
离子键没有方向性和饱和性
离子晶体的配位数也较高
典型结构有四种:AB、AB2、A,B3、 AB2O4,
离子晶体的结构规则
1.鲍林第一规则(负离子配位多面体规则):在离子晶体中,正离子周围形成一个负离子配位多面体,正负离子间的平衡距离取决于正负离子半径之和,正离子的配位数取决于正负离子的半径比。
2.鲍林第二规则(电价规则含义):一个负离子必定同时被一定数量的负离子配位多面体所共有。
3.鲍林第三规则(棱与面规则):在配位结构中,共用棱特别就是共用面的存在,会降低这个结构的稳定性。
4.鲍林第四规则一不同种类正离子多面体间连接规则
在含多种正离子的离子晶体中,电价高、配位数低的正离子配位多面体间,尽量互不结合
5. 鲍林第五规则一节约规则
同一品体同种正离子与同种负离子的结合方式应最大限度的趋于致
3 共价键晶体的结构
周期表中IV族元素C,Si, Ge,Sn的晶体属于共价品体结构。共价键结合,其特点是共用价电子使原子的外壳层满足稳定的8个电子,故在共价品体中,符合8-N原则,( N为该原子的价电子数),具有饱和性。
(1) 饱与性:一个原子的共价键数为 8-N。
(2) 方向性:各键之间有确定的方位
(配位数小,结构稳定)
5.聚合物晶态结构
聚集态结构(三次结构):
晶态结构和非晶态(无定形)结构
特点:聚合物晶态总是包含定量的非晶相;聚集态结构不仅与大分子链本身的结构有关,而且强烈地依赖于外界条件。